Wie orientieren wir uns?
Forschungsbericht (importiert) 2015 - Max Planck Institut für medizinische Forschung
Sich in seiner täglichen Umgebung orientieren zu können, ist überlebenswichtig. Doch wie bewältigen wir diese Aufgabe? Die Antwort ist unter anderem essenziell für das Verständnis von Demenzerkrankungen. An der Maus untersuchten Wissenschaftler, wie Informationen über ihre Umgebung gewichtet und für die Orientieren genutzt werden. Sie konnten zeigen, dass Nervenzellen der zentralen Gehirnregion, des Hippokampus, sog. NMDA-Rezeptoren nutzen, um widersprüchliche Informationen bei der Orientierung zu erkennen und zu bewerten – nicht, wie bisher vermutet, um Ortskenntnisse zu speichern.
Die Kommunikation zwischen Nervenzellen passt sich an
Wenn wir lernen, ändert sich etwas im Schaltplan unseres Gehirns. Intensive Forschungen der letzten 50 Jahre haben gezeigt, dass es Veränderungen in den Verbindungen (den sogenannten Synapsen) zwischen unseren Nervenzellen sind, die es uns ermöglichen zu lernen beziehungsweise erworbenes Wissen im Gedächtnis zu speichern. Manche Synapsen werden stabilisiert, andere abgebaut. An diesen Prozessen sind zahlreiche zelluläre Komponenten beteiligt, deren Ausfall zu Lern- und Gedächtnisstörungen führt. Von zentraler Bedeutung für den Umbau der Synapsen scheinen besondere Rezeptoren an der Oberfläche jeder Nervenzelle zu sein – die sogenannten NMDA-Rezeptoren. Sie vermitteln der Zelle den aktuellen Aktivitätszustand der Nervenverbindungen und teilen ihr mit, ob die eine oder andere Verbindung zu anderen Zellen optimiert oder abgeschaltet werden soll [1, 2].
Die Anpassung und Optimierung von Nervenverbindungen wird bereits bei der Reifung des Nervensystems im Embryo benötigt und dient unter anderem der Synchronisation konkurrierender Nervenverbände. Wie überlebenswichtig dieses rezeptorvermittelte Lernen ist, zeigen Mäuse, bei denen die NMDA-Rezeptoren genetisch entfernt wurden [3]. Die nach der Geburt stattfindende Synchronisation zwischen dem Atemrhythmus und dem beim Säugen wichtigen Schluckreflex gelingt nicht, was zum unmittelbaren Tod durch Unterernährung oder Sauerstoffmangel führt.
Räumliches Lernen ist unabhängig von der Anpassungsfähigkeit hippokampaler Nervenverbindungen
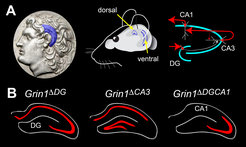
Abb. 1: Bilder zum Hippokampus. (oben, links) Münze mit Abbild von Alexander dem Großen. Er trägt aus Verehrung des Gottes Ammon widderhornähnliche Gebinde als Haarschmuck etwa an der Stelle des Hippokampus, der sich tief im Gehirn befindet und auch als Ammonshorn oder Cornus Ammonis bezeichnet wird. (oben, Mitte) Schematische Darstellung der Lage des Hippokampus in der Maus. Die Zellschichten mit NMDA-Rezeptor produzierenden Zellkörpern sind in blau gezeigt. (oben, rechts) Verschaltungsmuster im Hippokampus. (unten) NMDA-Rezeptor ‘Knockout’ (Ausschaltung) in Nervenzellen des Gyrus Dentatus (DG) von Grin1ΔDG Mäusen, der CA3-Region Grin1ΔCA3 Mäusen und der CA3- und DG-Region von Grin1ΔDGCA1 Mäusen (Die NMDA-Rezeptor-Expression ist in rot gezeigt).
Im Gegensatz zur Rolle der NMDA-Rezeptoren bei der Synchronisation von Nervenverbänden während der Entwicklung ist deren mögliche Funktion beim Lernen und bei der Gedächtnisbildung noch nicht klar. Beschädigungen definierter Gehirnbereiche in Mensch und Tier wiesen dem Hippokampus (Abb. 1) eine wichtige Rolle beim Kennenlernen neuer Umgebungen zu [2, 4]. Ob allerdings die hier beobachteten Lernschwächen auch dann auftreten, wenn nur die Anpassungsfähigkeit der Nervenverbindungen im Hippokampus abgeschaltet ist, weil die hippokampalen NMDA-Rezeptoren fehlen, ist unklar. Zur Beantwortung dieser Frage müssen die NMDA-Rezeptoren im Hippokampus von Versuchstieren gezielt entfernt und danach die Lernfähigkeit der Tiere beurteilt werden.
Ein solch präzises Experiment ist bisher nur mit speziell dafür generierten Mäusen durchzuführen. Wissenschaftlern am MPI für medizinische Forschung ist es gelungen, in zwei Mauslinien das Gen für den NMDA-Rezeptor in Teilregionen des Hippokampus auszuschalten und danach das Lernverhalten der Tiere zu untersuchen [5, 6].
Tiere mit Verlust der NMDA-Rezeptoren (konditionale Knockout-Mäuse) entweder im Gyrus Dentatus (ΔDG) oder im DG und Cornu Ammonis CA1 (ΔDG/CA1) wurden zuerst in einem Schwimmtest untersucht (Abb. 2).
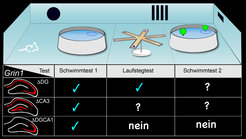
Abb. 2: (oben) Versuchsaufbauten zur Analyse des räumlichen Lernens. (unten) Alle Mutanten mit Verlust der NMDA-Rezeptoren in den Nervenzellen Gyrus Dentatus (ΔDG), der CA3-Region (ΔCA3) und der CA3- und DG-Region (ΔDGCA1) lernen die Position der untergetauchten Rettungsinsel. Die ΔDGCA1-Mäuse haben Probleme, sich erfolgreich im Raum zu orientieren, wenn die Futtersuche im sechsarmigen Laufstegtest oder dem Schwimmtest-2 erschwert wird.
Die Mäuse mussten eine unsichtbare Rettungsinsel in einem Schwimmbecken finden und deren Position lernen – wobei nur die Lage des Schwimmbeckens im Verhältnis zu Gegenständen im Raum als Orientierungshilfe diente. Diese Aufgabe konnten Mäuse nach Entnahme des Hippokampus nicht mehr bewerkstelligen [6]. Wider Erwarten konnten die Tiere mit intaktem Hippokampus, bei dem jedoch die CA1-NMDA-Rezeptoren fehlten, die Position der untergetauchten Insel lernen. Mit dem gleichen Test zeigte eine andere Arbeitsgruppe, dass diese Aufgabe auch dann gemeistert werden kann, wenn die NMDA-Rezeptoren in der dritten Hippokampusregion, dem Cornu Ammonis CA3, fehlen [7] (Abb. 2). Somit wurde in unabhängigen Experimenten gezeigt, dass die Position der Rettungsinsel auch dann gelernt und ins Gedächtnis übertragen werden kann, wenn die hippokampalen NMDA-Rezeptoren fehlen.
Beim Lernen werden unterschiedliche Informationen berücksichtigt
Die neuen Beweise, dass örtliche Gegebenheiten auch ohne hippokampale NMDA-Rezeptoren gelernt werden können, waren eindeutig. Sie widersprachen jedoch dem gängigen Lehrbuchwissen: Danach sind im dorsalen Hippokampus die Ortskenntnisse gespeichert, wofür die NMDA-Rezeptoren notwendig sein sollen [2].
Die Wissenschaftler am MPI für medizinische Forschung wollten diesen Widerspruch mit weiteren Experimenten klären. Dazu wurden die Mäuse in sechs sternförmig angeordneten, identischen Laufstegen getestet [6]. In dieser Lernaufgabe enthielten die Endpunkte von nur drei der sechs Laufstege Futter. Welche Stege Futter enthielten, konnten die Mäuse sich nur anhand der Lage der Laufstege merken (Abb. 2). Die Mäuse hatten auf diese Weise auch trotz Abwesenheit der NMDA-Rezeptoren in DG und CA1 gelernt, die Insel im Schwimmtest zu finden, und sollten daher die Laufstege mit Futter problemlos zuordnen können. Es zeigte sich aber, dass die Mäuse ohne NMDA-Rezeptoren in der DG-Region die drei Laufstege mit Futter nach mehreren Lernversuchen bevorzugt zur Futtersuche aufsuchten, während Mäuse, bei denen die Rezeptoren in den DG- und CA1-Regionen fehlten, auch die futterfreien Stege erkundeten (Abb. 3).
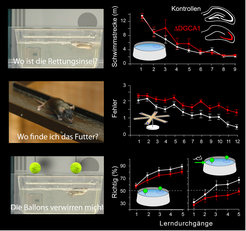
Abb. 3: Lernkurven von Mäusen mit Verlust der NMDA-Rezeptoren in Nervenzellen des Gyrus Dentatus und der CA1-Region (ΔDGCA1) von den drei Lernaufgaben [7] der Abbildung 3. Die Bilder in der linken Spalte zeigen die Mäuse bei der Bewältigung ähnlicher Aufgaben. Unten rechts ist auch die Lernkurve gezeigt (rechts), die erreicht wird, wenn die Maus den Schwimmtest in der Nähe des Ballons beginnt, der sich nicht oberhalb der Rettungsinsel befindet.
Das gezielte Aufsuchen der Stege mit Futter war also nur mit intakten NMDA-Rezeptoren in der CA1-Region möglich. Es lag nahe, dass die Laufstege an sich bei der Lösung der Aufgabe ein Problem darstellten. Die Wissenschaftler vermuteten, dass die Mäuse ohne CA1-NMDA-Rezeptor zwar die Lage der sechs Laufstege im Raum, wie zuvor die Lage der Insel im Schwimmtest, erkannten und lernten, aber einen Laufsteg als Information zu hoch und die jeweilige Lage der Laufstege zu niedrig bewerteten.
Der Hippokampus als Entscheidungsinstanz
Spielt also der CA1-NMDA-Rezeptor eine Rolle bei Entscheidungen darüber, welche Information im Raum wichtig ist? Um dies zu testen, wurde ein neues Lernexperiment durchgeführt [6]. Wieder wurde das Schwimmbecken mit der verborgenen Insel eingesetzt. Allerdings war nun ein Ballon oberhalb der verborgenen Insel befestigt und ein zweiter, identischer Ballon im gegenüberliegenden Viertel des Beckens (Abb. 2, 3). Die Position der Rettungsinsel konnte nur anhand der Lage des Beckens im Raum und nicht mit Hilfe der Ballons gelernt werden. Die Ballons mussten als unwichtige und nur die Lage des Beckens als zuverlässige Orientierungshilfe bewertet werden. Wie schon beim dem Laufstegtest konnten die Tiere ohne CA1-NMDA-Rezeptor auch diese Lernaufgabe nicht gut lösen: insbesondere dann nicht, wenn der Ballon ohne Insel viel einfacher zu erreichen war als der Ballon über der Rettungsinsel (Abb. 3). Anscheinend wurden die Ballons bei fehlendem NMDA-Rezeptor bevorzugt zur Orientierung benutzt, während die Raumorientierung keine Rolle spielte. Wurden jedoch im letzten Durchgang des Versuchs beide Ballons entfernt, so suchten alle Mäuse die Rettungsinsel an der richtigen Stelle. Dies war ein klarer Beweis, dass auch bei fehlenden CA1-NMDA-Rezeptoren die Position der Rettungsinsel gelernt und im Gedächtnis gespeichert wird. Die Rezeptoren waren allerdings notwendig, wenn irreführende Ballons innerhalb des Schwimmbeckens bei der Orientierung zu ignorieren waren. Somit entspricht die Rolle der CA1-NMDA-Rezeptoren der Funktion der NMDA-Rezeptoren bei Neugeborenen: In beiden Situationen signalisieren NMDA-Rezeptoren dem Gehirn, dass zwei widersprüchliche Informationen gemäß der momentanen Situation bewertet und, wenn nötig, miteinander abgestimmt werden müssen.
Durch das Entfernen des Hippokampus in Mäusen war deshalb weder die Erkennung der Lage des Beckens im Raum noch die Erkennung der Ballons, sondern nur die Entscheidung zwischen diesen beeinträchtigt. Somit scheint der CA1-NMDA-Rezeptor das Nervensystem in die Lage zu versetzen, zu entscheiden, ob die Position der Ballons oder die Lage des Beckens im Raum die wichtigere Information darstellt.
Auch bei einer Variante des Schwimmtests ohne Ballons musste über die Wichtigkeit einer neuen Information entschieden werden. Hier wurde, nachdem die Position der Insel gelernt worden war, diese an einer anderen Stelle angebracht. Es galt nun, in weiteren Durchläufen die neue Position zu lernen. Wie erwartet, lernten die Mäuse ohne CA1-NMDA-Rezeptoren die neue Position der Insel nur langsam [6]. Bei diesem Umlernen konkurrierten unterschiedliche Informationen nicht miteinander, neu zu lernen war nur deren räumliche Zuordnung. Dies erklärt, warum Umlernen nicht direkt von hippokampalen NMDA-Rezeptoren abhing, jedoch durch diese CA1-NMDA-Rezeptoren beschleunigt wird. Genau die gleichen Probleme beim Umlernen wurden bereits in Lernstudien mit Ratten oder Mäusen mit inaktiviertem CA1-NMDA-Rezeptor beschrieben und führten zu der Lehrbuchmeinung, dass der Hippokampus räumliche Information speichert [2]. Dabei wurde leider das Ausmaß der Inaktivierung der NMDA-Rezeptoren nicht so sorgfältig dokumentiert wie in der hier beschriebenen Studie, die nun anhand innovativer Lernexperimente und einer neuen Generation genetisch modifizierter Mäuse den Widerspruch zu den früheren Ergebnissen klären konnte.
Schlussbemerkung
Die hier vorgestellten Ergebnisse widersprechen dem herrschenden Dogma, wonach hippokampale NMDA-Rezeptoren für den Aufbau eines räumlichen Gedächtnisses benötigt werden, und weisen diesen Rezeptoren eine wesentliche Rolle bei der Entscheidungsfindung zu [8]. Sie verdeutlichen, warum eine übliche milde medikamentöse Inaktivierung der NMDA-Rezeptoren mit Memantin bei ersten Anzeichen einer Demenz die Gedächtnisbildung nicht unmittelbar behindert. Die Studien an Mäusen ohne hippokampalen NMDA-Rezeptor zeigen, dass bei der Therapie mit Memantin die Beurteilung der Entscheidungsfindung der Patienten mit einbezogen werden sollte. Künftige Experimente müssen klären, wo und wie Gehirnregionen bestimmte Informationen speichern und wie hippokampale NMDA-Rezeptoren diese Informationen abgleichen und uns auf neue Situationen aufmerksam machen.
Literaturhinweise
In Neuroscience in the 21st Century (New York: Springer), pp. 59-80 (2013)
In: The Hippocampus Book Andersen, P.; Morris, R.; D. Amaral, D.; Bliss, T.; O' Keefe, J. (New York: Oxford University Press, USA), 1st Edition, 9–36 (2007)


![Abb. 3: Lernkurven von Mäusen mit Verlust der NMDA-Rezeptoren in Nervenzellen des Gyrus Dentatus und der CA1-Region (ΔDGCA1) von den drei Lernaufgaben [7] der Abbildung 3. Die Bilder in der linken Spalte zeigen die Mäuse bei der Bewältigung ähnlicher Aufgaben. Unten rechts ist auch die Lernkurve gezeigt (rechts), die erreicht wird, wenn die Maus den Schwimmtest in der Nähe des Ballons beginnt, der sich nicht oberhalb der Rettungsinsel befindet. Abb. 3: Lernkurven von Mäusen mit Verlust der NMDA-Rezeptoren in Nervenzellen des Gyrus Dentatus und der CA1-Region (ΔDGCA1) von den drei Lernaufgaben](https://www.mpg.de/11625151/original-1508158072.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MjUxNTF9--a0c4281173cd7f7d075cfe8e9f09c697f3222b89)