Raketentreibstoff in Bakterien
Forschungsbericht (importiert) 2016 - Max Planck Institut für medizinische Forschung
Einleitung
Die meisten für Lebewesen typischen Moleküle enthalten Stickstoffatome, und alle Lebensformen auf der Erde sind von diesem Element ebenso abhängig wie von Kohlenstoff und Sauerstoff. In der Erdkruste ist Stickstoff eher selten, dafür besteht unsere Atmosphäre zu 80% daraus. Hier liegt der Stickstoff allerdings in molekularer Form vor, d.h. als zwei aneinander gebundene Stickstoffatome (N2), deren extrem starke Dreifachbindung nur sehr schwer spaltbar ist. In der Biosphäre spielen daher Organismen, die Stickstoff in eine reaktivere Form umwandeln und so für Lebewesen verfügbar machen, eine zentrale Rolle. In dieser „Stickstofffixierung“ spalten Bakterien unter enormem Energieaufwand die N2-Moleküle und bilden aus jedem zwei Moleküle Ammoniak (NH3). Diese Reaktion ist eine sogenannte Redoxreaktion, d.h., Elektronen werden abgegeben oder, wie in diesem Fall, aufgenommen. Ammoniak ist sehr viel reaktiver als der molekulare Stickstoff aus der Luft, und sein Stickstoff ist daher für biochemische Prozesse leicht verfügbar.
Solche spezialisierten, „diazotrophen“ Bakterien leben oft in Symbiose mit Pflanzen, die den so gebundenen Stickstoff für ihren Stoffwechsel erhalten. Es gibt jedoch andere Bakterien, die Ammoniak mit Hilfe von Luftsauerstoff in einer weiteren Redoxreaktion zu Nitrit (NO2-) umwandeln. Diese Organismen, Nitrifizierer genannt, gewinnen Energie aus diesem Vorgang, und das gebildete Nitrit kann ebenfalls von Pflanzen für ihr Wachstum verwendet werden.
Eine dritte Gruppe von Mikroorganismen, die denitrifizierenden Bakterien, können aus Nitrit in zwei aufeinanderfolgenden Redoxreaktionen wieder molekularen Stickstoff freisetzen: aus zwei Molekülen Nitrit entsteht zunächst Lachgas (N2O), das daraufhin wieder zu molekularem Stickstoff (N2) umgesetzt wird. Stickstoffatome durchlaufen also einen Zyklus: aus molekularem Stickstoff aus der Luft wird Ammoniak, und daraus wird Nitrit, das schließlich über Lachgas wieder in molekularen Stickstoff umgewandelt wird - der biologische Stickstoffkreislauf.
Aufgrund der enormen Bedeutung von Stickstoff für das Leben auf der Erde ist dieser Kreislauf bereits seit längerem Gegenstand vieler Forschungsarbeiten. Die Entwicklung eines chemischen Prozesses zur chemischen Fixierung von atmosphärischem Stickstoff als Ammoniak hat es ermöglicht, stickstoffhaltigen Mineraldünger im industriellen Maßstab herzustellen; dieses sogenannte Haber-Bosch-Verfahren hat zu riesigen Fortschritten in der Landwirtschaft geführt und zur Linderung des Hungers in der Welt beigetragen.
Eine Überraschung: die Anammox-Reaktion
Es war daher eine große Überraschung, als niederländische Forscher Mitte der neunziger Jahre feststellten, dass unser Verständnis des Stickstoffkreislaufs eigentlich unvollständig war. Aus einer Wasseraufbereitungsanlage isolierte man Bakterien, die Ammoniak und Nitrit in Abwesenheit von Sauerstoff direkt in molekularen Stickstoff umwandeln können [1]. Diese Reaktion, die als „anaerobe Ammoniumoxidation" oder „Anammox“-Reaktion bezeichnet wird, war eine bislang unbekannte Abkürzung innerhalb des Stickstoffkreislaufs.
Inzwischen sind Anammox-Bakterien überall auf der Erde entdeckt worden, und es wird angenommen, dass bei der Hälfte des gebundenen Stickstoffs, der aus den Ozeanen in die Atmosphäre zurückgeführt wird, dies über den Anammox-Prozess statt über die Denitrifizierung geschieht. Die Anammox-Reaktion ist also von globaler Bedeutung. Sie hat auch einen großen wirtschaftlichen Nutzen: da sich große Mengen Ammoniak und Nitrit (z.B. in Abwässern) schädlich auf die Umwelt auswirken, aber mit der Anammox-Reaktion sehr einfach in unschädliches Stickstoffgas verwandelt werden können, werden Anammox-Bakterien immer häufiger in Kläranlagen eingesetzt.
Raketentreibstoff in Bakterien?
Die Entdeckung der Anammox-Bakterien [1] war an sich schon eine Überraschung, aber die Aufklärung der einzelnen Reaktionsschritte selbst lieferte noch erstaunlichere Erkenntnisse. Es wurde nämlich festgestellt, dass beim Zusammenfügen der beiden Stickstoffatome aus Ammoniak und Nitrit zunächst Hydrazin gebildet wird [2, 3]. Hydrazin ist eine äußerst reaktive und für viele Organismen sogar giftige Substanz. Aufgrund ihrer hohen Energiedichte wird sie als Raketentreibstoff benutzt und darf nur unter strengsten Sicherheitsvorkehrungen gehandhabt werden. Es stellt sich also die Frage, wie Anammox-Bakterien dieses Hydrazin herstellen, unter Kontrolle halten und weiterverwenden. Am MPI für medizinische Forschung in Heidelberg wurden die molekularen Strukturen der Enzyme, die für die Hydrazinsynthese zuständig sind, intensiv untersucht.
Ungewöhnliche molekulare Strukturen
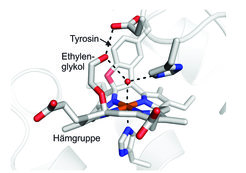
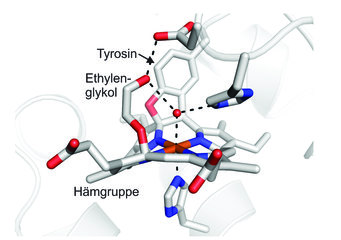
Als Erstes wurde die Hydroxylamin-Oxidase aus dem Anammox-Bakterium Kuenenia stuttgartiensis untersucht. Dieses Enzym wandelt Hydroxylamin (NH2OH) in Stickstoffmonoxid (NO) um, das dann zur Synthese von Hydrazin verwendet wird. Mithilfe der Proteinkristallographie konnte die dreidimensionale Struktur des Enzyms bestimmt werden [4]. Dabei fiel auf, dass die eisenhaltige Hämgruppe im aktiven Zentrum, die in den meisten anderen Hämproteinen mehr oder weniger flach ist, eine stark verbogene Form besitzt. Der Grund sind zwei sehr ungewöhnliche chemische Bindungen zwischen der Hämgruppe und einem Tyrosin, die zu einer starken Verzerrung der Hämstruktur führen (Abb. 1). Diese Verzerrung, die sonst nur bei einem verwandten Protein aus einem nitrifizierenden Bakterium bekannt war, hat starke Auswirkungen auf die chemischen Eigenschaften des Enzyms. Dies wurde unter anderem klar, als die Forscher herausfanden, dass das Hämmolekül nicht nur wie üblich am Eisenatom Reaktivität aufweist, sondern auch an einer ganz anderen, unerwarteten Stelle. Durch Zufall wurde entdeckt, dass ein sonst eher unreaktives Molekül, Ethylenglykol, eine chemische Bindung mit einem der Kohlenstoffatome dieser außergewöhnlichen Hämgruppe bildet [5].
Eine biologische Hydrazinfabrik
Als nächstes untersuchten die Forscher die Struktur des Enzyms Hydrazinsynthase, das aus Ammoniak und Stickstoffmonoxid Hydrazin herstellt. Obwohl Kristalle dieses Enzyms hergestellt werden konnten, reichte ihre Qualität nicht für die Strukturbestimmung. Ein aufwändiges Suchverfahren ergab, dass sich die Qualität durch Zugabe von Betain erhöhen ließ – allerdings lösten sich die Kristalle bei normalen Temperaturen langsam auf. In einem eigens konzipierten Kühlgerät konnten die Kristalle kontrolliert auf -20 Grad Celsius abgekühlt werden. Auf diese Weise entstanden Kristalle, die eine sehr detaillierte Bestimmung der Struktur der Hydrazinsynthase ermöglichten [6].
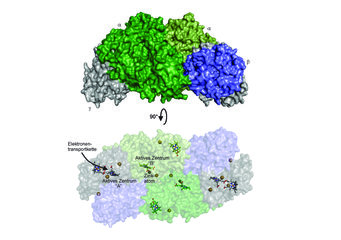
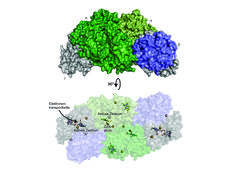
Die katalytische Wirkung der Enzyme liegt in ihrem aktiven Zentrum. Interessanterweise zeigte die Strukturbestimmung, dass die Hydrazinsynthase, die aus mehreren interagierenden Proteinmolekülen besteht, zwei unterschiedliche aktive Zentren besitzt (Abb. 2). Eines davon (aktives Zentrum A) befindet sich am Ende einer möglichen Elektronenübertragungskette, was nahelegt, dass hier eine Redoxreaktion stattfindet. Das andere aktive Zentrum (B) zeigt wiederum eine sehr ungewöhnliche Struktur, die Elemente aus aktiven Zentren verschiedener Enzymfamilien in sich vereint: Zum einen befindet sich hier eine Hämgruppe, deren Eisenatom wie im Enzym Katalase mit einem Tyrosin interagiert, zum anderen ist dort aber auch ein Zinkatom gebunden, und zwar auf eine Weise, die an manche proteinspaltende Enzyme erinnert. Außerdem zeigte die Strukturanalyse, dass die beiden aktiven Zentren durch ein System von Tunneln miteinander verbunden sind (Abb. 3).
Fasst man diese und weitere Erkenntnisse zur Hydrazinsynthase zusammen, kann man sich vorstellen, dass die Synthese von Hydrazin in zwei Schritten abläuft: im einen aktiven Zentrum findet der erste Schritt statt, dessen Produkt dann durch den Tunnel zum anderen aktiven Zentrum transportiert wird, wo der zweite Schritt erfolgt. Die Struktur der einzelnen aktiven Zentren erlaubte es, einen detaillierten, in sich schlüssigen Mechanismus für diesen Vorgang vorzuschlagen (Abb. 3).
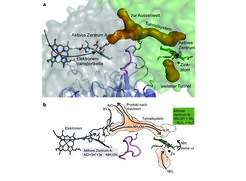
In diesem mechanistischen Modell wird zunächst in einem der beiden aktiven Zentren (A) Stickstoffmonoxid (NO) in Hydroxylamin (NH2OH) umgewandelt. Dies ist eine Redoxreaktion, und die erforderlichen Elektronen stammen aus der Elektronentransportkette, deren Ende am aktiven Zentrum A liegt. Das entstandene NH2OH bewegt sich dann durch den Tunnel zum aktiven Zentrum B. Dort reagiert es in einer sogenannten „Komproportionierung“ mit Ammoniak zu Hydrazin. Die Hydrazinsynthase ähnelt also einer „biologischen Fabrik“, mit Reaktionsgefäßen und Leitungen für Chemikalien. Tatsächlich erinnert dieser Mechanismus in mancher Hinsicht an das „Raschig-Verfahren“ zur industriellen Herstellung von Hydrazin.
Anammox-Forschung in der Zukunft
Wie sich gezeigt hat, hält die Biochemie von Stickstoffverbindungen immer noch große Überraschungen für uns bereit, insbesondere in der Anammox-Reaktion. Um unsere Kenntnisse über die Biochemie dieser global so wichtigen Reaktion zu erweitern, untersucht man derzeit die Proteine, welche die für die unterschiedlichen Reaktionen notwendigen Elektronen vom einen Enzym zum anderen transportieren. Auch wird die Struktur der Hydrazindehydrogenase, die Hydrazin in molekularen Stickstoff umwandelt, untersucht [7].