Fluoreszierende Sonden für die Biologie
Forschungsbericht (importiert) 2020 - Max Planck Institut für medizinische Forschung
Einleitung
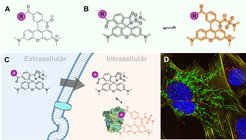
Fluoreszenzmikroskopie, kombiniert mit Strategien zur selektiven Markierung von Biomolekülen mit Fluorophoren, hat sich in den letzten Jahrzenten als Methode der Wahl zur Beobachtung von Biomolekülen in lebenden Zellen etabliert. Jedoch ist es seit jeher eine enorme Herausforderung, synthetische Fluoreszenzsonden zu entwickeln, die für solche Experimente geeignet sind [1]. Eine Fluoreszenzsonde für die Lebendzellmikroskopie muss eine Reihe von Anforderungen erfüllen: (i) eine gute Fähigkeit, die Zellmembran zu überwinden (Zellpermeabilität), (ii) eine spezifische Markierung des Zielobjekts, (iii) eine hohe Helligkeit und Photostabilität und (iv) geeignete Anregungs-/Emissions-wellenlängen. Die meisten bisher entwickelten Fluoreszenzsonden, die für die Lebendzellmikroskopie geeignet sind, basieren auf Rhodamin-Derivaten, wie Tetramethylrhodamin (TMR; Abbildung 1A), einem Fluoreszenzfarbstoff, der bereits vor circa 140 Jahren eingeführt wurde. Obwohl TMR ein heller und photostabiler Fluorophor ist, reduziert seine zwitterionische Struktur seine Zellpermeabilität und damit seine Eignung für die Lebendzellmikroskopie. Darüber hinaus zeigen TMR und andere klassische Rhodamine geringe fluorogene Eigenschaften - dieser Term beschreibt die Zunahme der Fluoreszenzintensität bei Bindung einer Fluoreszenzsonde an ihr Zielmolekül. Fluorogene Eigenschaften sind in der Lebendzellmikroskopie wünschenswert, da sie den Anteil von Hintergrundsignalen durch Fluorophore, die nicht an ihr Zielmolekül gebunden sind, reduzieren und damit den relativen Anteil „echter“ Signale erhöhen.
Neue Tricks für alte Fluorophore
Wir haben nun eine allgemein anwendbare Strategie entwickelt, um klassische Rhodamine wie TMR in fluorogene Sonden mit exzellenter Zellpermeabilität und geringem Hintergrundsignal umzuwandeln. [2] Sie basiert auf der Derivatisierung der in TMR und anderen Rhodaminen vorkommenden Carboxylgruppe in ein elektronenarmes Amid, wie das in Abbildung 1B dargestellte Acyl-N,N-dimethylsulfamid von TMR (von uns als MaP555 bezeichnet, was für „Max-Planck-Sonde mit einem Anregungsmaximum von 555 nm“ steht). Diese chemische Modifikation hat keinen Einfluss auf die spektroskopischen Eigenschaften des Fluorophors, aber sie ermöglicht es ihm, in einem dynamischen Gleichgewicht zwischen zwei verschiedenen Formen zu existieren: einem fluoreszierenden Zwitterion und einem nicht fluoreszierenden Spirolactam. Die Existenz eines solchen dynamischen Gleichgewichts zwischen einer fluoreszierenden und nicht fluoreszierenden Form erscheint auf den ersten Blick nachteilig, da es die Helligkeit des Fluorophors reduzieren könnte. Allerdings besitzt das hydrophobe, nicht fluoreszierende Spirolactam eine höhere Zellpermeabilität als sein zwitterionisches Gegenstück. Wenn nun MaP555 an einen Liganden gekoppelt wird, der eine Affinität für ein bestimmtes Biomolekül besitzt, konnten wir außerdem beobachten, dass die Bindung dieser MaP555-Sonde an das Biomolekül das Gleichgewicht zurück in seinen fluoreszierenden, zwitterionischen Zustand verschiebt (Abbildung 1C). Die Umwandlung von TMR in MaP555 schlägt somit zwei Fliegen mit einer Klappe: Es erhöht die Zellpermeabilität und führt zu fluorogenen Eigenschaften. Vorteilhaft ist weiterhin, dass der synthetische Zugang zu dieser Art von Amiden relativ einfach ist, so dass die Strategie auf verschiedene Rhodamine mit unterschiedlichen Farben angewendet werdenkann. Dies wird auch dadurch vereinfacht, dass Variationen der Struktur des elektronenarmen Amids es uns erlauben, das Gleichgewicht zwischen dem fluoreszierenden Zwitterion und dem Spirolactam für jedes Rhodamin so einzustellen, dass eine maximale Permeabilität und gute fluorogene Eigenschaften erreicht werden können.
Hell und schnell
MaP-Sonden in verschiedenen Farben ermöglichen nun Experimente, bei denen mehrere Biomoleküle in derselben Zelle markiert und abgebildet werden. Ein repräsentatives Bild eines solchen Lebendzellmikroskopie-Experiments ist in Abbildung 1D zu sehen. Das Bild entstand durch die Inkubation von Zellen mit vier unterschiedlich gefärbten, fluoreszierenden Sonden, die jeweils an ein anderes Biomolekül binden, und deren direkte Abbildung, ohne dass ungebundene Sonde weggewaschen werden muss. Dieses Bild gibt uns nicht nur einen Einblick in das Innenleben einer Zelle, sondern auch einen Ausblick auf die Zukunft der Lebendzellmikroskopie, in der „intelligente Sonden“ in Verbindung mit ausgefeilten Mikroskopie-Techniken es uns ermöglichen, jene Aspekte der Biologie sichtbar zu machen, die für unsere Augen derzeit noch unsichtbar sind.
