Gezielte chemische Kontrolle von Proteinwechselwirkungen
Forschungsbericht (importiert) 2021 - Max Planck Institut für medizinische Forschung
Einleitung
Die Funktionsweise von Proteinen ist häufig davon abhängig, wie makromolekulare Komplexe mit verschiedenen zellulären Komponenten assoziiert sind. Daher sind Untersuchungen an isolierten Proteinen außerhalb der lebenden Zelle hinsichtlich ihrer Aussagekraft zur Proteinfunktion begrenzt. Zwar können mit biochemischen Methoden Proteinwechselwirkungen identifiziert werden, doch deren Bedeutung auf die Zelle zu übertragen gestaltet sich schwierig. Deshalb ist es für die Zellbiologie essenziell, Technologien und molekulare Werkzeuge zur Verfügung zu haben, um die verschiedenen Akteure, die an einem zellulären Prozess beteiligt sind, in ihrem natürlichen zellulären Umfeld zu manipulieren.
Ein Großteil unseres Verständnisses zellbiologischer Mechanismen geht tatsächlich auf den Einsatz von Strategien zur Störung der Funktion von Proteinen im zellulären Kontext zurück. Hierzu zählen genetische knock-out Ansätze, knock-down RNA-Interferenz (RNAi) oder die Anwendung kleiner Moleküle als Wirkstoffe.
Mit chemischen Induktoren von Proteinnähe (CIP) zur gezielten Annäherung von Proteinen
Ein Problem bei gentechnischen Manipulationen ist deren zeitliche Dauer, so dass der Einsatz der Methode von der Entwicklungsgeschwindigkeit des Organismus abhängt, oder, wie im Falle der RNAi, von der Halbwertszeit des zu untersuchenden Proteins. Im Gegensatz zu gentechnischen Eingriffen verläuft die Störung eines Proteins durch einen kleinen molekularen Wirkstoff sehr schnell und ist oft umkehrbar. Chemische Induktoren von Proteinnähe (chemical inducers of protein proximity, kurz CIP) sind solche kleinen Moleküle, die dazu geeignet sind, Manipulationen in Zellen vorzunehmen, indem sie Proteine in unmittelbare Nähe zueinander bringen. Ein CIP definiert sich durch die Fähigkeit, zwei gleiche oder verschiedene Proteindomänen zu binden und so einander anzunähern.
Unsere Arbeitsgruppe am Max-Planck-Institut für medizinische Forschung hat nun einen neuartigen CIP entwickelt, der sich einerseits durch besonders hohe Effizienz auszeichnet, andererseits durch seine hervorragende Fähigkeit, in die Zelle einzudringen. Diese Eigenschaften erlauben unter anderem den Einsatz zur Proteinmanipulation in Modellorganismen wie dem Zebrafischbärbling (Danio rerio) [1].
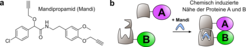
Die gezielte Adressierung gewünschter Zielproteine erreicht man über genetische Veränderung: Die Zielproteine werden mit den CIP bindenden Proteindomänen als Fusionsproteine im gewünschten Organismus exprimiert. Anschließend löst man zu einem gewünschten Zeitpunkt durch Zugabe des CIPs die Annäherung der Zielproteine aus (Abb. 1). Die räumliche Nähe bestimmter Proteine spielt bei einer Vielzahl biologischer Prozesse eine zentrale Rolle, wie beispielsweise bei der Transkription, Signalweiterleitung, Chromatinbildung bzw. -regulierung und Proteinfaltung.
Kontrolle von Protein-Proteinwechselwirkungen in Zebrafischbärblingen
In den letzten Jahren konnte gezeigt werden, dass Pflanzenhormone, wie Gibberellinsäure (GA3) oder Abscisinsäure (ABA), für die Anwendung als CIPs in Säugerzellen geeignet sind [2]. Indem sie spezifisch an entsprechende Pflanzenhormonrezeptoren binden, können sie Protein-Protein-Interaktionen in Pflanzen auslösen, welche wiederum das Pflanzenwachstum oder die Stressresistenz in Pflanzen regulieren. Die entsprechenden Bindungsdomänen lassen sich auch in Säugerzellen exprimieren und können durch die Zugabe des entsprechenden Pflanzenhormons in Nähe zueinander gebracht werden. Dabei haben GA3 und ABA über die gezielte Manipulation der Zielproteine hinaus keinen Einfluss auf andere Prozesse in Säugerzellen. Allerdings können beide Pflanzenhormone die Zellmembran nur schwer überwinden, was ihren Einsatz insbesondere in in vivo Anwendungen begrenzt.
Wie unsere Arbeitsgruppe herausfand, besitzt das kleine, nicht-natürliche Molekül Mandipropamid die Fähigkeit, eine Mutante (PyRMandi) des natürlichen ABA-Rezeptors PYR1 (Pyrabactin resistance 1) mit außergewöhnlich hoher Effizienz zu binden und darüber hinaus, analog zu ABA, die Proteininteraktion mit dem Protein ABI (Abscisic acid insensitive) zu induzieren. Mandipropamid ist eine organisch- chemische Verbindung, die normalerweise in der Landwirtschaft als Fungizid zur Bekämpfung des falschen Mehltaus Einsatz findet. Sie besitzt eine hohe Fähigkeit zur Penetration von Zellen und Geweben, und wir konnten zeigen, dass Mandipropamid als CIP mit PyRMandi die Proteininteraktionin in bereits sehr viel geringeren Konzentrationen induzieren kann als ABA mit dem natürlichen PYR1-Rezeptor.
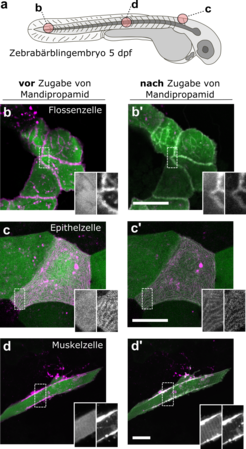
Für die Untersuchung von Proteinnähe ist die "fluoreszenzmikroskopische Kolokalsationsanalyse" besonders gut geeignet. Sind Zielproteine mit unterschiedlichen Fluoreszenzsonden markiert, lässt sich untersuchen, ob sich die markierten Proteine im gleichen Bereich der Zelle befinden (kolokalisiert sind). Mit der Anwendung dieser Methode in Embryonen von Zebrafischbärblingen konnten wir zeigen, dass bereits eine geringe Konzentration Mandipropamid (500 nM) nach wenigen Minuten die Kolokalisation der Bindungsdomänen auch in tieferliegenden Geweben induzieren kann (Abb. 2). Eine solche gezielte und schnelle Kontrolle von Proteinwechselwirkungen in Modellorganismen wie dem Zebrafischbärbling war zuvor mit anderen CIPs nicht möglich – sie ist ein großer Vorteil für die Untersuchung entwicklungsbiologischer Prozesse.
Forschungswerkzeug mit Potential für therapeutische Anwendung
Angesichts unserer Ergebnisse erwarten wir, dass auf Mandipropamid basierende Technologien ein vielseitiges und weit verbreitetes Werkzeug zur Manipulation der Proteinlokalisierung und -interaktion in der zellbiologischen Forschung sowie für das Design von Proteinnetzwerken in der synthetischen Biologie sein werden. In Anbetracht der jüngsten Fortschritte bei Gentherapien und der Entwicklung von Wirkstoffen zum gezielten Proteinabbau haben CIP-Systeme neben ihrer Nützlichkeit als Forschungswerkzeuge auch das Potential, therapeutisch Anwendung zu finden.

