Premiere in der künstlichen Zellteilung
Einem Forschungsteam ist es erstmals gelungen, einen wichtigen Baustein für künstliche Zellen mithilfe von DNA-Nanotechnologie zu entwickeln: einen Ring aus DNA-Nanoröhren, der bei der künstlichen Zellteilung zum Einsatz kommen könnte.
Bei der Zellteilung bildet sich um den Zelläquator ein Ring aus Proteinen, der sich zusammenzieht und so die Zelle in zwei Tochterzellen trennt. Wissenschaftler*innen vom Max-Planck-Institut für medizinische Forschung in Heidelberg und dem Zentrum für molekulare Biologie der Universität Heidelberg ist es in Kooperation mit Forschenden aus Dortmund, Dresden, Tübingen und Harvard erstmals gelungen, einen solchen kontraktilen Ring künstlich mit Hilfe von DNA-Nanotechnologie herzustellen und den Kontraktionsmechanismus zu verstehen. Die Ergebnisse wurden in der Fachzeitschrift Nature Communications veröffentlicht.
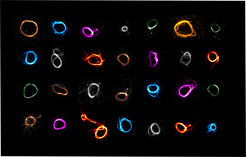
In der synthetischen Biologie versuchen Wissenschaftler*innen, wesentliche Mechanismen des Lebens wie die Zellteilung im Reagenzglas nachzubauen oder zu imitieren. Ziel ist es, Zellen künstlich herstellen zu können, die sich aus möglichst wenigen Bestandteilen zusammensetzen. Ein Team um Kerstin Göpfrich vom Max-Planck-Institut für medizinische Forschung und der Universität Heidelberg hat nun kontraktile Ringe für die Zellteilung synthetisch nachgebildet. Die Polymerringe bestehen dabei aus DNA-Nanoröhren.
Ringbildung entscheidend für Zellteilung
Ein wesentlicher Schritt bei der natürlichen Zellteilung ist die Bildung eines Rings, der die zu teilenden Zellen trennt, indem er sich zusammenschnürt. In der Natur ist eine Maschinerie aus Proteinen dafür zuständig: Ein Ring aus Fäden des Proteins Aktin wird dabei durch Motorproteine, die durch chemische Energie aus ATP-Hydrolyse angetrieben werden, zusammengezogen. Adenosintriphosphat, kurz ATP, ist ein Molekül, das in allen lebenden Zellen vorkommt und die Energie für zahlreiche Prozesse liefert.
Neue künstliche Alternative zu natürlichen Motorproteinen
Die von den MPI-Forscher*innen Kerstin Göpfrich, Maja Illig und Kevin Jahnke entwickelten DNA-Ringe zeichnen sich dadurch aus, dass der synthetische Kontraktionsmechanismus nicht mehr auf die ATP-getriebenen Motorproteine angewiesen ist. Stattdessen ziehen sich die Polymerringe aufgrund einer molekularen Anziehung zwischen Ringsegmenten zusammen.
Die molekulare Anziehung kann auf zwei Weisen entstehen: entweder durch vernetzende Moleküle, die mit zwei „klebenden“ Enden zwei Segmente verbinden, oder durch eine Wechselwirkung, wo die Polymere mit Molekülen umgeben werden, die die Segmente aneinanderdrücken. Dieser Mechanismus verbraucht keine chemische Energie, was bedeutet, dass in der synthetischen Zelle keine Energiequelle für diesen Mechanismus eingebaut werden muss.
Vollständig synthetische Teilungsmaschine im Blick
„Wir sind überzeugt, erst am Anfang zu stehen. Unsere Neuentwicklung macht uns Mut, von einer vollständig synthetischen Teilungsmaschine für synthetische Zellen zu träumen“, sagt Forschungsgruppenleiterin Kerstin Göpfrich. „Proteine können sich nicht selbst kopieren. Daher glauben wir, dass eine auf Nukleinsäure basierende Maschinerie für synthetische Zellen eine Abkürzung zur Schaffung von künstlichem Leben sein könnte.“
Die Theorie und Simulation, die die Experimente unter ihrer Federführung unterstützen, können quantitativ erklären, wie die Polymerringe sich bilden und zusammenziehen. Auf dieser Grundlage lässt sich bestimmen, wie der DNA-Ringdurchmesser präzise kontrolliert werden kann, was für zukünftige Anwendungen der kontraktilen Ringe in der synthetischen Biologie von großer Bedeutung ist.
Mechanismen zur Zellteilung sind ein wichtiger Schritt auf dem Weg zu einer künstlichen Modellzelle. Die Konstruktion künstlicher Zellen erlaubt es, die Funktionsmechanismen natürlicher Zellen und damit die Grundlagen des Lebens besser zu verstehen.
Hinweis: Der Originaltext der Pressemeldung stammt von der TU Dortmund und wurde in dieser Version leicht verändert.
