Vom Baustein zum Gift: Der tödliche Mechanismus von Zeta-Toxinen
Forschungsbericht (importiert) 2011 - Max Planck Institut für medizinische Forschung
Toxin-Antitoxin-Systeme
Bakterien sind bekannt für ihre Fähigkeit, sich mit einer – evolutionär betrachtet – rasanten Geschwindigkeit an neuartige Umweltbedingungen anzupassen. Im Rahmen dieser Wandlungsfähigkeit erwerben Bakterien scheinbar aus dem Nichts Gene, die es ihnen beispielsweise erlauben, Antibiotika abzubauen, Gifte zu produzieren oder neuartige Lebensräume zu besiedeln. Doch woher kommt dieses genetische Material und warum kann es sich so schnell verbreiten? Die Ursache hierfür liegt in der Fähigkeit von Bakterien, mittels „horizontalem Gentransfer“ Erbinformationen untereinander auszutauschen. Dabei werden die von wenigen Zellen evolutionär erworbenen Eigenschaften mit bemerkenswerter Geschwindigkeit sogar oft über Artgrenzen hinweg verbreitet. Das geschieht entweder über die Aufnahme von extrazellulärer DNA abgestorbener Zellen, über Infektionen mit Viren (sogenannten Bakteriophagen), oder den Austausch von DNA-Elementen durch direkten Zell-Zell-Kontakt. Vor allem bei den letzten beiden Mechanismen spielen sogenannte mobile genetische Elemente (MGE) eine wichtige Rolle. Diese „DNA-Vehikel“ transportieren oft mehrere funktionelle Gene, wie z. B. Resistenzgene, und können sich entweder direkt in das bakterielle Chromosom einbauen oder werden unabhängig davon als sogenannte Plasmide innerhalb der Zelle mitgeführt und weitervererbt.
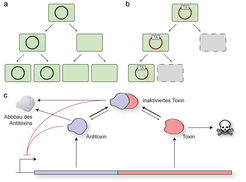
Allerdings werden viele mobile genetische Elemente oft nur sehr instabil im bakteriellen Genom verankert und können insbesondere während der bakteriellen Zellteilung wieder verloren gehen (Abb. 1a). Die dadurch entstehenden „ballastfreien" Zellen können nun in Abwesenheit des Antibiotikums schneller wachsen und sollten daher aller Erwartung nach ihre resistenten Artgenossen nach und nach verdrängen. Um der damit verbundenen Eliminierung aus dem Genom der bakteriellen Populationen zu entgehen, bedienen sich viele MGEs sogenannter Toxin-Antitoxin-Systeme (Abb. 1b, c). Diese kleinen DNA-Abschnitte kodieren einerseits ein stark toxisches Protein („Toxin“) mit dem Potenzial, das Bakterium zu vergiften, andererseits aber auch das dazu passende „Antitoxin“, welches dieses Toxin neutralisiert [1]. Nimmt nun ein Bakterium ein MGE auf, das ein TA-System mit sich bringt, produziert es automatisch neben dem Toxin immer auch das Antitoxin und entgeht somit einer Vergiftung. Das Dilemma für das Bakterium liegt nun in der Instabilität des Antitoxins: Da dieses kurz nach seiner Herstellung durch zelluläre Abbaumechanismen wieder zerstört wird, ist die Zelle auf eine ständige Neusynthese des Gegengifts angewiesen, um der Vergiftung durch das Toxin zu entgehen. Verliert nun eine Zelle das MGE, verliert es auch das Gen für das Antitoxin und somit die Fähigkeit, das Gegengift herzustellen. Dadurch wird das stabilere Toxin, das immer noch in der Zelle vorhanden ist, freigesetzt und es kommt zum „programmierten“ Zelltod von Bakterien, die das mobile genetische Element verloren haben.
Obwohl dieser Stabilisierungsmechanismus die ursprüngliche Funktion von TA-Systemen zu sein scheint, zeigen neueste Untersuchungen, dass einige Systeme im Laufe der Evolution von Bakterien zweckentfremdet wurden: Während manche Bakterienarten durch eine kontrollierte Aktivierung der Toxin-Komponente ihr Wachstum in Kulturen regulieren [2], nutzen andere Spezies TA-Systeme, um „Selbstmord“ von Zellen auszulösen, die sich mit Bakteriophagen infiziert haben [3]. Dadurch wird verhindert, dass sich die Vireninfektion weiter in der Bakterienpopulation ausbreiten kann. Durch diese oft noch unbekannten Funktionen, sowie ihre Rolle bei der Erhaltung von Resistenzgenen, sind TA-Systeme in den letzten Jahren vermehrt in den Fokus mikrobiologischer Forschung gerückt. Insbesondere liefert dabei die Aufklärung der verschiedenen Aktivierungsmechanismen der Toxin-Komponenten als auch ihrer bakteriotoxischen Wirkungsweise wertvolle Hinweise für den Kampf gegen multiresistente Keime.
Epsilon/Zeta-Systeme
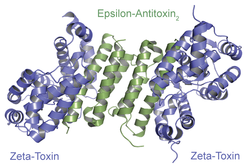
Eine weit verbreitete TA-Familie sind die sogenannten Epsilon/Zeta-Systeme, die Resistenzplasmide in vielen gefährlichen multiresistenten Keimen stabilisieren [4]. Wie bei klassischen TA-Systemen verweilt das Toxin „Zeta“ im Komplex mit seinem Antitoxin „Epsilon“ als inaktive Variante in der Zelle (Abb. 2). Wenn aber durch Verlust des Plasmids die Fähigkeit verloren geht, das Epsilon-Antitoxin neu herzustellen, tötet das nun freiwerdende Zeta-Toxin die Trägerzelle. Daneben gibt es in vielen Pathogenen auch chromosomale Epsilon/Zeta-Systeme, bei denen das Zeta-Toxin einen direkten Einfluss auf die Virulenz zu haben scheint. So ist ein Zeta-Toxin, bekannt als PezT, in hochpathogenen Pneumokokken-Stämmen direkt an der Ausbildung von schweren, besonders schnell verlaufenden Infektionen in Mausmodellen beteiligt [5] [6].
Obwohl Epsilon/Zeta-Systeme schon vor fast 20 Jahren entdeckt wurden, war der tödliche Mechanismus der Zeta-Toxine bis vor kurzem unbekannt: Ein großes Problem bei der Untersuchung der Wirkungsweise von Zeta-Toxinen war ihre hohe Toxizität in Bakterien. Diese machte einerseits ein molekularbiologisches Arbeiten mit den Toxin-Genen schwierig und führte andererseits zu einem so schnellen Absterben von bakteriellen Zellen, dass keine Rückschlüsse auf den Vergiftungsmechanismus gezogen werden konnten.
Tod durch innere Vergiftung

Durch einen besonderen Trick gelang es jedoch kürzlich am Heidelberger Max-Planck-Institut für medizinische Forschung, das Rätsel der Zeta-Toxine zu lösen und ihre Wirkungsweise aufzuklären [7]: Durch das Verkürzen der Proteinsequenz des Zeta-Toxins PezT wurde zunächst eine Variante erzeugt, deren toxische Aktivität reduziert war. Diese Veränderung erlaubte anschließend eine genaue Untersuchung der Vergiftungssymptome des Zeta-Toxins im Modellbakterium Escherichia coli. Dabei konnten die Forscher nachweisen, dass unter dem Einfluss des Zeta-Toxins bakterielle Zellen ähnliche Vergiftungserscheinungen zeigen wie nach einer Behandlung mit dem Antibiotikum Penicillin: Zu Beginn der Vergiftung verlor die Mehrzahl der Zellen die Fähigkeit sich erfolgreich zu teilen, um dann aufzuplatzen und zu sterben (Abb. 3). In der Tat zeigten weitere Untersuchungen, dass Zeta-Toxine ganz ähnlich wie Penicillin den Aufbau der bakteriellen Zellwand verhindern. Da diese als strukturgebendes Außenskelett verhindert, dass Bakterien durch ihren hohen Eigendruck platzen, führt eine Inhibierung ihres Synthesewegs insbesondere bei im Wachstum begriffenen bakteriellen Zellen schnell zum Tod.
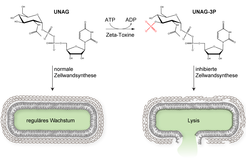
In weiteren Untersuchungen konnte schließlich der molekulare Mechanismus dieser Vergiftung durch Zeta-Toxin aufgeklärt werden. Dabei zeigte sich, dass das Toxin ein bisher unbekannter Vertreter aus der Enzymklasse der Phosphotransferasen ist, der den für den Aufbau der bakteriellen Zellwand essentiellen Zuckerbaustein UNAG (UDP-N-Acetylglucosamin) modifiziert. Im Zuge dieser Aktivität katalysieren Zeta-Toxine den Transfer einer Phosphatgruppe an eine definierte Stelle des Zuckermoleküls (Abb. 4). Dabei verwandelt sich UNAG vom wichtigsten Grundbaustein zu einem Inhibitor der bakteriellen Zellwandsynthese: Das modifizierte Molekül UNAG-3P vergiftet dabei ähnlich wie Penicillin enzymatisch katalysierte Reaktionen, die grundlegend für den Aufbau der Zellwand sind.
Kontrollierter Zelltod von Pneumokokken?
Wie lässt sich nun erklären, warum das Zeta-Toxin PezT die Virulenz von Pneumokokken erhöht? Eine weitere am Institut durchgeführte Studie hat gezeigt, dass PezT im Gegensatz zu anderen Zeta-Toxinen von seinem Antitoxin mit einer der höchsten jemals gemessenen Protein-Protein-Affinitäten neutralisiert wird [8]. In diesem hochstabilen Toxin-Antitoxin-Komplex wird das Antitoxin vor einem kontinuierlichen Abbau geschützt. Daher ist zu vermuten, dass die Aktivierung von PezT in Pneumokokken von einem bisher unbekannten Prozess kontrolliert wird. Dieser könnte bewirken, dass PezT nur unter bestimmten, bisher noch unbekannten Bedingungen aktiviert wird und so zum Zelltod einer Subpopulation an Pneumokokken führt. Diese „Autolysis“ ist ein bei Pneumokokken häufig zu beobachtendes Phänomen, bei dem verschiedene, toxische Substanzen frei werden, die die Immunabwehr abschwächen oder die Besiedlung von Gewebe erleichtern.
Schlussfolgerungen
Da UNAG von allen Bakterien universell für den Aufbau der Zellwand verwendet wird, lässt sich die speziesübergreifende Wirksamkeit von Zeta-Toxinen und die damit verbundenen Stabilisierungen von Resistenzgenen erklären. Darüber hinaus ist die bisher unbekannte Substanz UNAG-3P ein wertvoller Grundstoff für die Entwicklung neuartiger Antibiotika. Des Weiteren wird ein genaueres Verständnis des Aktivierungsmechanismus von PezT und verwandten Zeta-Toxinen einen wichtigen Beitrag zum Verständnis der Rolle von TA-Systemen für pathogene Bakterien leisten



