Neues Verfahren des Molekularen Engineering ermöglicht komplexe Organoide
Ein interdisziplinäres Forschungsteam verwendet Mikrokugeln aus DNA, um die Entwicklung von gezüchtetem Gewebe zu steuern.
Mithilfe eines neuen Verfahrens des Molekularen Engineering können Organoide gezielt in ihrer Entwicklung beeinflusst werden. Zum Einsatz kommen dabei Mikrokugeln aus gezielt designter DNA, die im Inneren der Gewebestrukturen Wachstumsfaktoren oder andere Signalmoleküle freisetzen. Dadurch entstehen wesentlich komplexere Organoide, die die entsprechenden Gewebe besser nachahmen und einen realistischeren Zellmix aufweisen als bisher. Entwickelt hat diese neue Technologie ein interdisziplinäres Forschungsteam des Exzellenzclusters „3D Matter Made to Order“ mit Wissenschaftler*innen des Centre for Organismal Studies und des Zentrums für Molekulare Biologie der Universität Heidelberg, des Instituts für Theoretische Physik und des BioQuant-Zentrums der Universität Heidelberg sowie des Max-Planck-Instituts für medizinische Forschung in Heidelberg.
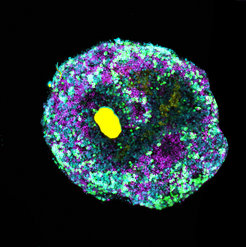
Organoide sind kleine, organähnliche Gewebestücke, die aus Stammzellen gewonnen werden. Sie werden in der Grundlagenforschung eingesetzt, um neue Erkenntnisse zur menschlichen Entwicklung zu gewinnen oder um die Entstehung von Krankheiten zu untersuchen. „Bislang war es nicht möglich, das Wachstum solcher Gewebestrukturen aus ihrem Inneren heraus zu kontrollieren“, sagt Dr. Cassian Afting, wissenschaftlich tätiger Mediziner am Centre for Organismal Studies (COS). „Mit dem neuartigen Verfahren können wir nun genau bestimmen, wann und wo im heranwachsenden Gewebe entscheidende Entwicklungssignale ausgelöst werden“, betont Tobias Walther, Biotechnologe und Doktorand am Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH) sowie am Max-Planck-Institut für medizinische Forschung (MPImF) in Heidelberg.
Mikrokugeln aus DNA als Helfer
Dazu konstruierte das interdisziplinäre Forschungsteam aus Biolog*innen, Mediziner*innen, Physiker*innen und Materialwissenschaftler*innen mikroskopisch kleine Kugeln aus DNA, die sich mit Proteinen oder anderen Molekülen „beladen“ lassen. Diese Mikrokugeln werden den Organoiden injiziert und geben ihre Fracht unter Einstrahlung von UV-Licht ab. Dadurch können Wachstumsfaktoren oder andere Signalmoleküle zu jedem beliebigen Zeitpunkt und an jeder beliebigen Stelle in dem sich entwickelnden Gewebestück freigesetzt werden.
Experimentell und theoretisch überprüft
Das Verfahren überprüften die Wissenschaftler an Netzhautorganoiden des Japanischen Reisfisches Medaka, indem sie mit einem Wnt-Signalmolekül beladene Mikrokugeln zielgenau in das Gewebe einbrachten. Damit gelang es erstmals, Zellen des retinalen Pigmentepithels – der äußeren Schicht der Netzhaut – dazu zu bringen, sich in direkter Nachbarschaft zu neuroretinalem Gewebe zu bilden. Mit früheren Ansätzen, Wnt in Zellkulturen einzubringen, wurde zwar das Wachstum von Pigmentzellen angeregt, aber die Bildung von neuronaler Netzhaut unterdrückt.
Realistischerer Mix von Zelltypen erreicht
„Dank der lokalisierten Freisetzung von Signalmolekülen erreichen wir einen realistischeren Mix aus Zelltypen und kommen damit der zellulären Zusammensetzung eines natürlichen Fischauges wesentlich näher als mit herkömmlichen Zellkulturen“, erläutert Prof. Dr. Kerstin Göpfrich, die am ZMBH und am MPImF auf dem Gebiet der synthetischen Biologie forscht. Die experimentellen Daten zu den Morphogen-Gradienten wurden durch Simulationen und Theorien von Prof. Dr. Ulrich Schwarz vom Institut für Theoretische Physik und dem BioQuant-Zentrum sowie von Oliver Drozdowski, einem Doktoranden der Max Planck School Matter to Life, untermauert.
Flexible Anpassung eröffnet vielfältiges Potenzial
Nach Angaben der Wissenschaftler können die DNA-Mikrokugeln flexibel angepasst werden, um viele verschiedene Signalmoleküle in unterschiedlichen Arten von gezüchtetem Gewebe zu transportieren. „Das eröffnet neue Möglichkeiten für das Engineering von Organoiden mit verbesserter zellulärer Komplexität und Organisation“, sagt Prof. Dr. Joachim Wittbrodt, dessen Forschungsgruppe am COS angesiedelt ist.
Er erläutert die vielen Möglichkeiten, die sich durch diese Zusammenarbeit ergeben: „In Zukunft wird die Zusammenarbeit mit der Gruppe Theoretischer Physiker um Ulrich Schwarz sehr hilfreich sein, um unser Design durch Berechnung zu verbessern. Komplexere Organoidmodelle, die auf Fortschritten in der Materialwissenschaft wie der DNA-Technologie basieren, könnten die Forschung auf dem Gebiet der menschlichen Entwicklung und Krankheit beschleunigen und potenziell auch die Organoid-basierte Wirkstoffforschung bereichern.“
Teamwork zusammen mit MPImF
Das neue Verfahren zur Erzeugung komplexer Organoide entstand im Exzellenzcluster „3D Matter Made to Order“, das gemeinsam von der Universität Heidelberg und dem Karlsruher Institut für Technologie getragen wird. Gefördert wurden die Arbeiten vom Europäischen Forschungsrat (ERC) im Rahmen eines ERC Starting Grant für Kerstin Göpfrich und der Deutschen Forschungsgemeinschaft. Ein Paper mit den Forschungsergebnissen ist in der Fachzeitschrift „Nature Nanotechnology“ erschienen.
Hinweis: Der Originaltext der Pressemeldung stammt von der Universtität Heidelberg und wurde in dieser Version leicht verändert.
