Im Auge des Betrachters – Signalverarbeitung in der Retina
Forschungsbericht (importiert) 2007 - Max Planck Institut für medizinische Forschung
Ein beträchtlicher Teil unseres Gehirns ist mit der Verarbeitung visueller Information beschäftigt. Dieser Prozess beginnt bereits im Auge, genauer gesagt, in der Netzhaut (Retina). Hier wird nicht nur der ins Auge fallende Photonenfluss in elektrische Signale umgewandelt, sondern es findet bereits eine erste Analyse der gesehenen Szene statt. Schon das Verhältnis von Photorezeptoren zu Ganglienzellen – das sind die Ausgangsneurone der Retina – von etwa 120:1 beim Menschen lässt das erahnen.
In der Tat gleicht die Retina einem Spezialprozessor zur Bildverarbeitung: sie übermittelt nicht nur Objekteigenschaften wie Helligkeit, Kontrast und „Farbe“ an das Gehirn, sondern gewinnt auch räumlich-zeitliche Informationen wie „Umrisse“ (Kanten), Bewegung und deren Richtung. Mit diesen Berechnungen leistet die Retina zum Beispiel einen ersten Beitrag zur Erkennung von Objekten vor einem Hintergrund (Segregation) [1], eine Funktion, die bis vor kurzem noch allein höheren visuellen Arealen im Gehirn zugeordnet wurde.
Die Retina ist ein Teil des Gehirns, der leicht isoliert werden kann und, entsprechend mit Sauerstoff und Nährstoffen versorgt, für Stunden oder sogar Tage in der Petrischale funktionell intakt bleibt. Im Gegensatz zu anderen Teilen des Gehirns kann die isolierte Retina mit natürlichen Reizen (Lichtmustern) stimuliert werden. Die Verarbeitung solcher Lichtreize lässt sich dann vergleichsweise einfach in Zwischenstufen (in den retinalen Interneuronen) oder als „Resultat“ (in den Ganglienzellen) messen. Damit eignet sich die Netzhaut hervorragend für das Studium der neuronalen Informationsverarbeitung, sowohl auf zellulärer Ebene als auch im Netzwerk.
Vielfalt an Interneuronen
Ermöglicht wird die Verarbeitungsleistung der Retina durch etwa 70 verschiedene Typen von Nervenzellen. Sie sind in „Schaltkreisen“ organisiert, die sich mit dem Herausfiltern unterschiedlicher Informationen aus Lichtreizen beschäftigen. Die Mehrheit dieser Nervenzelltypen sind Interneurone, d.h. ihre Fortsätze verbleiben innerhalb der Retina.
Eine Klasse solcher Interneurone sind die Bipolarzellen, die direkten Eingang von den Photorezeptoren erhalten. Bipolarzellen stellen parallele Kanäle dar, die Signale mit unterschiedlichen chromatischen, zeitlichen und räumlichen Eigenschaften von den Photorezeptoren zu Ganglien- und Amakrinzellen leiten. Letztere bilden mit knapp 40 Typen die umfangreichste Klasse von retinalen Interneuronen. Es wird angenommen, dass sie die „Hardware“ darstellen, auf der ein wesentlicher Teil der retinalen Signalverarbeitung beruht.
Die Rolle der Amakrinzellen ist es, vereinfacht gesagt, das Antwortverhalten der Ganglienzellen (direkt und indirekt über Rückkopplung mit den Bipolarzellen) so zu modulieren, dass sie auf bestimmte Reizeigenschaften ansprechen. Angesichts dieser wichtigen Funktion überrascht es, dass mehr als 100 Jahre, nachdem die morphologische Vielfalt der Amakrinzellen zum ersten Mal vom spanischen Anatomen Ramón y Cajal dokumentiert wurde, die Funktion von nur einer Hand voll dieser Zellen wirklich gut verstanden ist. Mehr über die Funktion von Interneuronen zu erfahren, ist nicht nur für das Verständnis der Signalverarbeitung in der Retina, sondern auch für das in anderen Gehirnteilen wichtig. Schon die wenigen funktionell gut beschriebenen Amakrinzellen besitzen sehr unterschiedliche Funktionen [2]. Zum Beispiel koppelt ein Typ lokal die Signalpfade für das Tag- und Nachtsehen, ein anderer hingegen leitet Signale über Millimeter hinweg weiter und koordiniert so die Aktivität entfernter Netzhautgebiete (siehe auch [1]). Eine weitere Amakrinzelle – wegen ihrer Ähnlichkeit mit einer Feuerwerksexplosion „Starburst“-Zelle genannt (Abb. 1A) – spielt bei der Berechnung der Bewegungsrichtung von Objekten eine entscheidende Rolle [3,4,5]; der überwiegende Teil dieses Artikels beschäftigt sich mit Funktion und synaptischer Verschaltung dieses Neurons.
Optophysiologische Aktivitätsmessungen in der Retina
Wie die meisten Amakrinzellen (gr. amakrin =ohne lange Fasern) besitzen „Starburst“-Zellen keine eindeutige Ausgangsstruktur wie ein Axon; ihre Dendriten erhalten gleichzeitig synaptischen Eingang und bilden Ausgangssynapsen. Um etwas über die Funktionsweise dieser Zellen zu erfahren, ist es daher notwendig, die lokale Aktivität in den Dendriten zu messen. In der Retina sind diese oft sehr dünnen Nervenfortsätze eng mit denen benachbarter Zellen verflochten und daher in der Regel unzugänglich für direkte elektrische Messungen mittels Elektroden. Optophysiologische Techniken (z.B. „Calcium imaging“) mit fluoreszierenden Aktivitätsindikatoren erlauben jedoch die Messung lokaler Signale in den Fortsätzen von Neuronen. Sie benötigen aber normalerweise sichtbares Anregungslicht, welches die Photorezeptoren bleicht und somit eine Stimulation mit Lichtreizen unmöglich macht. Einen eleganten Ausweg bietet die Zwei-Photonen (2P) -Mikroskopie [6]: das hier zur Anregung der Indikatoren benutzte unsichtbare Infrarotlicht des Lasers ermöglicht optophysiologische Aktivitätsmessungen in der Retina bei gleichzeitiger Lichtstimulation [7,3,4].
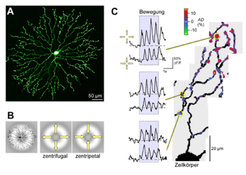
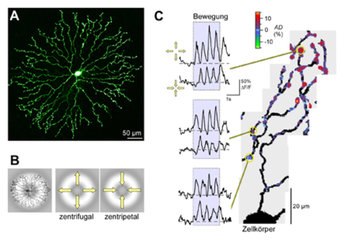
Zelluläre Mechanismen der Richtungsselektivität
Vor mehr als 40 Jahren wurden erstmals retinale Ganglienzellen beschrieben, die spezifisch auf bewegte Lichtreize reagieren [8]: Je besser die Bewegungsrichtung eines Objekts mit einer bestimmten von den Ganglienzellen bevorzugten Bahn übereinstimmt, desto heftiger antworten sie. Sie sind somit richtungsselektiv („direction selective“, abgekürzt DS) und leiten Informationen über Bild- und Objektbewegungen an das Gehirn weiter (zur Übersicht siehe [5]). Die synaptischen Eingangssignale, die DS-Ganglienzellen empfangen, sind bereits richtungsabhängig; die eigentliche Richtungsberechnung muss daher in vorgeschalteten Zellen stattfinden. DS-Ganglienzellen beziehen einen wesentlichen Teil ihrer Eingangssignale von „Starburst“-Amakrinzellen (SACs). Mit 2P-mikroskopischen Messungen konnten die Wissenschaftler um Thomas Euler in der Abteilung von Winfried Denk in Kooperation mit Peter Detwiler (University of Washington, Seattle, USA) zeigen, dass SACs in ihren Dendriten richtungsselektive Ca2+-Signale generieren [3]; die lokale Ca2+-Konzentration steigt an, wenn sich der Lichtreiz vom Zellkörper weg in Richtung der Dendritenenden bewegt (Abb. 1B). Die Neurotransmitterausschüttung an den Synapsen zwischen SACs und DS-Ganglienzellen ist Ca2+-abhängig, daher stammt zumindest ein Teil der richtungsselektiven Eingangsignale in den DS-Ganglienzellen von den SACs. Möglicherweise tragen auch andere Mechanismen als der hier diskutierte zur robusten Richtungsselektivität der DS-Ganglienzellen bei (diskutiert in [5]).
Um ein richtungsselektives Signal in den SACs zu erzeugen, reichen die Eingangssignale von den Bipolarzellen allerdings aus; Inhibition durch benachbarte SACs oder andere Amakrinzellen im Umfeld spielt, anders als bisher gedacht, eine untergeordnete Rolle [4]. Eine SAC antwortet zwar, wenn die Helligkeit im Umfeld moduliert wird, nicht aber wenn dort Bewegungsreize mit konstanter mittlerer Helligkeit präsentiert werden. Dies bedeutet, dass Informationen über die Bewegungsrichtung nicht von benachbarten Zellen übermittelt werden (Le Sun, Shigang He, Chinese Academy of Sciences, Beijing, China; S. E. Hausselt, T. Euler, W. Denk).
So „rechnen“ Dendriten ...
Wie aber berechnen die SAC-Dendriten die Bewegungsrichtung eines Lichtreizes? In Experimenten, bei denen die Antworten von SACs auf Variationen von bewegten Lichtreizen mit elektrischen und optophysiologischen Methoden gemessen wurden, stellte sich heraus, dass die dendritische Richtungsberechnung wesentlich auf den spezifischen elektrischen Membraneigenschaften der Zellen beruht [4]. Die Messdaten weisen auf einen beständigen Unterschied in der Membranspannung zwischen Zellkörper und Dendritenenden hin. Deshalb verhalten sich spannungsabhängige Ionenkanäle in den zellkörpernahen Dendritenbereichen etwas anders als solche in der Nähe der Dendritenspitze. Die resultierende Asymmetrie sorgt dafür, dass die von den Bipolarzellen stammenden Eingangssignale abhängig vom räumlich-zeitlichen Muster, mit dem sie entlang des SAC-Dendriten eintreffen, unterschiedlich verstärkt werden. So ändert sich die Membranspannung richtungsabhängig und führt damit auch zu einer richtungsabhängigen Neurotransmitterausschüttung.
Die durch Lichtreize ausgelösten Ca2+-Signale sind überwiegend im äußeren Drittel der Dendriten zu beobachten und sind nicht gleichmäßig verteilt, sondern treten in „hotspots“ auf (Abb. 1C) (X. Castell, W. Denk, T. Euler). Die „hotspots“ befinden sich meist auf dendritischen Verdickungen (Varikositäten); dort sitzen auch die Ausgangssynapsen der SACs. Die Lokalisierung und Diversität der Ca2+-Signale – manche „hotspots“ besitzen eine von der zentripetalen Richtung abweichende oder gar keine Richtungsselektivität – sprechen für eine lokale Entstehung der Ca2+-Signale. Für eine Beteiligung von lokalen, intrazellulären Mechanismen spricht auch der Befund, dass, anders als beispielsweise in Ganglienzellen, die Ca2+-Signale in SACs nicht sehr robust sind. Störungen des intrazellulären Milieus, wie sie bei elektrischen Ganzzellmessungen nie ganz auszuschließen sind, führen zum Verlust der Signale [4]. Pharmakologische Experimente deuten darauf hin, dass in der Tat ein „Auswaschen“ von intrazellulären Signalmolekülen die Ursache sein könnte.
Was ist der Grund für eine derart komplexe Signalgenerierung? Aus der Tatsache, dass SACs zwei verschiedene Neurotransmitter ausschütten, lässt sich eine mögliche Erklärung ableiten: Die Beschränkung der Ca2+-Signale auf bestimmte Kompartimente (die Varikositäten) und die Beteiligung von intrazellulären Signalwegen könnte notwendig sein, um die richtungsabhängige Änderung der Membranspannung differenziell, d.h. abhängig vom Transmitter (bzw. postsynaptischen Partner), in ein synaptisches Ausgangssignal zu übersetzen. Eines der derzeitigen Ziele der Wissenschaftler in Heidelberg ist es, diese Hypothese zu überprüfen.
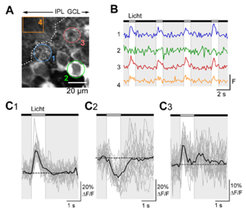
Viraler Gentransfer in retinale Neurone
Aufgrund ihrer Zugänglichkeit eignet sich die Retina hervorragend für genetische Manipulationen mittels viraler Vektoren. Neben einem möglichen medizinischen Nutzen der viralen Genübertragung in die Retina bietet diese Technik neue Möglichkeiten, Fragen der Signalverarbeitung, wie der in SACs, anzugehen. So sind pharmakologische Effekte, wie z.B. die von Rezeptorantagonisten auf die Lichtantworten von SACs, manchmal schwer zu interpretieren, weil die Antagonisten nicht nur die untersuchte Zelle selbst, sondern auch oder auch nur die vorgeschalteten Zellen beeinflussen können. Die zelltypspezifische Unterdrückung bestimmter Kanäle oder Rezeptoren, beispielsweise mittels „gene silencing“, bietet hier neue Ansatzpunkte. Xavier Castell und Kollegen (Mazahir Hasan, Julia Mack-Bucher, T. Euler, W. Denk) konnten zeigen, dass genetisch kodierte Ca2+-Indikatoren in Ganglienzellen viral exprimiert werden können und funktionell sind (Abb. 2). Zurzeit loten die Wissenschaftler Möglichkeiten aus, die virale Expression auf bestimmte retinale Zelltypen zu konzentrieren.
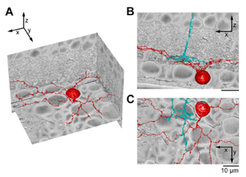
Richtungsselektivität benötigt selektive Verschaltung
Um die korrekte Übertragung der Richtungsinformation von den SACs zu den DS-Ganglienzellen zu gewährleisten, müssen die synaptischen Verschaltungen zwischen den beiden Zelltypen sehr selektiv sein (diskutiert in [5]). Diese Frage konnte bisher auf ultrastrukureller Ebene nicht systematisch untersucht werden, da das zu rekonstruierende Volumen (von mind. 300x300x50 µm3) das mit traditionellen Ansätzen Erreichbare übersteigt. Mithilfe neu entwickelter elektronenmikroskopischer (EM) Techniken und automatisierter Rekonstruktionsverfahren [9,10] haben Wissenschaftler um Winfried Denk angefangen, die Verschaltung der inneren plexiformen Schicht, die auch die richtungsselektiven Schaltkreise enthält, aufzuklären (Abb. 3) (Kevin Briggman, Moritz Helmstädter, S. E. Hausselt, T. Euler, W. Denk). Eine weitere sehr interessante Frage ist, wann und wie der Schaltkreis während der Entwicklung verdrahtet wird: Es gibt nämlich Hinweise darauf, dass DS-Ganglienzellen bereits zu dem Zeitpunkt richtungsselektiv sind, wenn die Retina lichtempfindlich wird.

![Beispiele für Neurone in der Kaninchenretina, die von Hand aus einem EM-Datensatz rekonstruiert wurden. Der Datensatz wurde mit einer Technik gewonnen, die als „serial block-face scanning electron microscopy“ bezeichnet wird und bei der Ultramikrotom und Elektronenmikroskop in einem Gerät kombiniert sind [9,10].
A: Eine teilweise rekonstruierte „Starburst“-Amakrinzelle (rot) mit Zellkörper und einem Teil des Dendritenbaumes.
B,C: Seitenansicht (B) und Draufsicht derselben „Starburst“-Zelle (rot); zusätzlich ist das Axonterminalsystem einer rekonstruierten Bipolarzelle (blau) gezeigt. Beispiele für Neurone in der Kaninchenretina, die von Hand aus einem EM-Datensatz rekonstruiert wurden. Der Datensatz wurde mit einer Technik gewonne](https://www.mpg.de/385131/zoom-1293749342.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6Mzg1MTMxfQ%3D%3D--2ef1ff634ea7ecfe6a831c5deaca8ea4e62ae05a)