Einem alten Bekannten auf der Spur
Erster Biosensor zur Echtzeitbestimmung zellulärer Coenzym-A-Konzentrationen
Die Abteilung Chemische Biologie am MPI für medizinische Forschung hat einen Biosensor entwickelt, der es erstmals erlaubt, Konzentrationsänderungen des Kofaktors Coenzym A (CoA) in lebenden Zellen zu verfolgen und absolute zelluläre CoA-Konzentration in Echtzeit zu bestimmen. Die Arbeit wurde kürzlich in der Fachzeitschrift Nature Chemical Biology veröffentlicht.
Coenzym A (CoA) ist als Kofaktor von großer Bedeutung für den zellulären Stoffwechsel. Als Kofaktoren bezeichnet man nicht-proteinogene Stoffe, organische Verbindungen, die für die katalytische Aktivität einer Vielzahl von Enzymen essentiell sind. Das CoA und seine acetylierte Form, das Acetyl-CoA („aktivierte Essigsäure“), werden für zentrale Prozesse im zellulären Stoffwechsel benötigt, wie beispielsweise den Zitronensäurezyklus, die Cholesterinbiosynthese, den Aminosäurestoffwechsel und nicht zuletzt den Fettsäurestoffwechsel. Auch in der Regulation zellulärer Prozesse ist CoA in seiner acylierten Form als Substrat für die Acylierung, eine wichtige regulative Postmodifikation von Proteinen, von besonderer Bedeutung.
Historisch ist die Erforschung des Coenzyms A eng mit dem Max-Planck-Institut für medizinische Forschung in Heidelberg verknüpft. Theodor Wieland, Direktor am Institut von 1967 bis 1981, untersuchte während seiner Promotionsarbeit beim vormaligen Direktor und Nobelpreisträger Richard Kuhn Struktur und Biogenese des Vitamins B5. Dieses, auch als Pantothensäure bezeichnet, ist wichtiger Ausgangspunkt der CoA-Biosynthese. Fritz Lipmann, ehemals Doktorand des Mitbegründers des Instituts für medizinische Forschung Otto Meyerhof und nach dessen Eröffnung 1930 für 2 Jahre an diesem tätig, erhielt für die Isolierung und Entdeckung des CoA den Nobelpreis für Medizin im Jahr 1953. Die erstmalige Strukturaufklärung und Isolierung der acetylierten Form des CoA (dem Acetyl-CoA) gelang dem Schwager Wielands und späterem Nobelpreisträger Feodor Lynen.
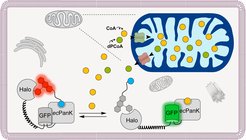
Ein Team aus der Abteilung Chemische Biologie des MPI für medizinische Forschung unter der Leitung von Kai Johnsson und Lin Xue hat sich nun der Herausforderung gestellt, diesem „alten Bekannten“, dem CoA, unmittelbar in der Zelle seine Geheimnisse zu entlocken. Aufgrund der zentralen Bedeutung des CoA für die Zelle ist es nicht überraschend, dass Dysregulationen der CoA-Konzentration mit verschiedenen Krankheiten in Zusammenhang gebracht werden. Für das Studium der zellulären Regulation des CoA-Spiegels und dessen pathophysiologischer Bedeutung muss die Konzentration von CoA zu verschiedenen Zeitpunkten und innerhalb verschiedener zellulärer Kompartimente ausgelesen werden können. Um einen Biosensor zu entwickeln, der eine solche CoA-Bestimmung innerhalb der Zelle ermöglicht, wurde das von Kai Johnsson zuvor etablierte Snifit-Konzept verwendet. Snifits sind Sensorproteine, die ein Bindungsprotein für den Analyten, ein selbstmarkierendes Protein (SLP) und ein fluoreszierendes Protein enthalten. Das SLP ist selektiv mit einem fluoreszierenden Liganden markiert. Die Bindung des Analyten (hier CoA) an den Sensor führt nun zu einer Farbänderung des emittierten Lichtes, und die Analytkonzentration lässt sich damit unmittelbar über die Bestimmung der Farbe des emittierten Lichtes auslesen.
Formal klingt die Realisierung des Snifit-Konzepts für einen beliebigen Analyten recht einfach. Die Schwierigkeit liegt jedoch in der Wahl geeigneter Einzelkomponenten des Snifits. Welches den Analyten bindende Protein eignet sich für den Sensor? Für dieses muss ein Ligand existieren, der mit dem Analyten um dieselbe Bindungsstelle konkurriert. Welche Anordnung der Komponenten im Snifit resultiert in einem gut auslesbaren Signal? Lin Xue, Postdoc in der Abteilung und Erstautor der in Nature Chemical Biology erschienenen Studie, konnte diese Schwierigkeiten alle lösen und einen CoA-Snifit entwickeln. Allerdings war einiges an Detailarbeit notwendig, um den finalen CoA-Snifit zu erhalten. „Die Unterscheidung des Sensors zwischen CoA und seiner acetylierten Form, dem Acetyl-CoA, war eine besondere Herausforderung, die wir durch Einführung gezielter Mutationen in der Bindungsdomäne des Sensors lösen konnten“, sagt Lin Xue. Mit dem neu entwickelten CoA-Snifit war es dem Team nun erstmals möglich, CoA-Konzentrationen in Säugerzellen zu bestimmen und die Schlüsselenzyme zu identifizieren, die für die Regulation der CoA-Konzentration eine zentrale Rolle spielen. Mit der Entwicklung von Biosensoren als Werkzeug zur In-situ-Bestimmung von Metabolitkonzentrationen in der Zelle folgt die Abteilung von Direktor Kai Johnson ganz dem Credo Feodor Lynens: „Die Natur ist immer unvorhersehbar, und die einzige Methode, ein biochemisches Problem aufzugreifen, ist, Experimente zu machen“. Mit dem neuen CoA-Snifit ist es nun möglich, diese Experimente unmittelbar in der Zelle durchzuführen. Die Abteilung erwartet den Einsatz des Biosensors als Werkzeug zum Studium des CoA und seiner Pathophysiologien in vielen Laboren weltweit.
